向1LFeBr2溶液中,通入1.12L(标态下)的Cl2,测得溶液中c(Br-)=3c(Cl-),反应过程中溶液的体积变化不计,则下列说法中正确的是( )
A.原溶液的浓度为0.1mol/L
B.反应后溶液中c(Fe3+)=0.1mol/L
C.反应后溶液中c(Fe3+)=c(Fe2+)
D.原溶液中c(Br-)=0.4mol/L
B.反应后溶液中c(Fe3+)=0.1mol/L
C.反应后溶液中c(Fe3+)=c(Fe2+)
D.原溶液中c(Br-)=0.4mol/L
所属分类:
化学
(免费栏目)
浏览量: 72 次
解:还原性Fe2+>Br-,所以FeBr2溶液中通入Cl2,Cl2先将Fe2+氧化为Fe3+,Fe2+反应完毕,若Cl2有剩余,剩余Cl2再将Br-氧化为Br2,最后溶液中含有Br-,说明Cl2完全反应,转化为Cl-.1.12L(标态下)Cl2的物质的量为0.05mol,根据氯元素守恒可知n(Cl-)=0.1mol,则溶液中n(Br-)=3n(Cl-)=0.3mol.
若溶液中Br-参加反应,令溶液中FeBr2物质的量为xmol,则根据电子转移守恒,x+(2x-0.3)=0.1,解得x=2/15mol,2/15mol
Fe2+的提供电子为 2/15mol,大于0.05molCl2能够获得电子0.1mol,且(2x-0.3)<0,不符合题意.
若溶液中Br-未参加反应,则原溶液中的Fe2+物质的量为0.15mol,0.15molFe2+能够提供电子0.15mol,0.05molCl2能够获得电子0.1mol,小于0.15molFe2+能够提供电子0.15mol,Fe2+有剩余,符合题意,所以原溶液含有FeBr20.15mol,根据电子转移守恒,被氧化的Fe2+为0.05mol×2=0.1mol,生成Fe3+为0.1mol,剩余Fe2+为0.15mol-0.1mol=0.05mol.B、由上述分析可知,反应后溶液中生成Fe3+为0.1mol,反应后溶液中c(Fe3+)=0.1mol/1L=0.1mol/L,故B正确;
C、由上述分析可知,反应后溶液中生成Fe3+为0.1mol,反应后溶液中c(Fe3+)=0.1mol/1L=0.1mol/L,剩余Fe2+为0.15mol-0.1mol=0.05mol,所以c(Fe2+)=0.05mol/1L=0.05mol/L,故C错误;
D、由上述分析可知,原溶液含有FeBr20.15mol,原溶液中c(Br-)=
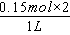 =0.3mol/L ,故D错误。
=0.3mol/L ,故D错误。故选B.
以上为百科题库网整理的关于"向1LFeBr<sub>2</sub>溶液中,通入1.12L(标态下)的Cl<sub>2</sub>,测得溶液中c(Br<sup>-</sup>)=3c(Cl<sup>-</sup>),反应过程中溶液的体积变化不计,则下列说法中正确的是( )"试题答案及解析,如想学习更多化学类竞赛题,欢迎访问www.baiketk.com查看搜索更多相关信息。
转载请注明:百科题库网https://www.baiketk.com/q_m6087b125eab2c.html
相关题目推荐
- 下列情况不会造成室内空气污染的是( )
- 2008年北京奥运会将办成绿色奥运,空气质量日益受到人们的关注.下列物质中,未计入北京市空气质量日报中监测空气污染指数的是( )
- 为配合今年6月5日的世界环境日,北京开展了“为首都多一个蓝天,我们每月少开一天车”的主题活动.下列说法正确的是( )
- 下列物质不属于“城市空气质量日报”报道的是( )
- 燃放烟花爆竹会产生一种有刺激性气味能污染空气的气体,它是( )
- 人们对空气污染程度的关注不断加强,我市也是空气污染比较严重的城市之一.下列气体中可以造成空气污染的有:①NO<sub>2</sub> ②NO ③CO ④CO<sub>2</sub> ⑤SO<sub>2</sub>( )
- 近日太原市民积极响应“绿色出行”的倡议,弃车步行.少开车可减少排放的有害气体是( )
- 2007年苏州市政府对公共交通的财政支持力度不断加强,对购置低污染排放公交车辆的补贴预计达1600万元.下列说法与改善空气质量关系最为密切的是( )
- 产生下列现象与向大气中排放的物质无关的是( )
- 今年春天,不同寻常的低温导致北极上空差点形成臭氧洞.臭氧(O<sub>3</sub>)属于( )
- 我市是全国十大宜居城市之一,人们对空气污染关注的程度不断加强,下列气体中不会造成空气污染的是( )
- 早在三年前,北京就推出“单车总动员”迎奥运首都公共自行车行动.许多市民也开始不开汽车,改骑自行车上班.从环保角度看,这主要是有利于减少城市的( )