将1.12g铁粉加入25mL 2mol•L-1的氯化铁溶液中,充分反应后,其结果是( )
A.铁有剩余,溶液呈浅绿色,Cl-浓度基本不变
B.往溶液中滴入无色KSCN溶液,显黄色
C.Fe2+和Fe3+的物质的量之比为6:1
D.氧化产物与还原产物的物质的量之比为2:5
B.往溶液中滴入无色KSCN溶液,显黄色
C.Fe2+和Fe3+的物质的量之比为6:1
D.氧化产物与还原产物的物质的量之比为2:5
所属分类:
化学
(免费栏目)
浏览量: 83 次
解:铁粉的物质的量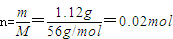 ,氯化铁的物质的量n=C×V=2mol?L-1×0.025L=0.05mol,铁粉与氯化铁的离子反应方程式为:Fe+2Fe3+=3Fe2+,根据反应的物质的量之比等于计量数之比知,0.02mol铁粉完全反应需要0.04mol氯化铁,所以氯化铁剩余0.01mol,生成的Fe2+的物质的量为0.06mol。
,氯化铁的物质的量n=C×V=2mol?L-1×0.025L=0.05mol,铁粉与氯化铁的离子反应方程式为:Fe+2Fe3+=3Fe2+,根据反应的物质的量之比等于计量数之比知,0.02mol铁粉完全反应需要0.04mol氯化铁,所以氯化铁剩余0.01mol,生成的Fe2+的物质的量为0.06mol。
B.氯化铁剩余,向溶液中滴入无色KSCN溶液,显血红色,故B错误。
C.Fe2+的物质的量为0.06mol,氯化铁的物质的量为0.01mol,所以Fe2+和Fe3+的物质的量之比为6:1,故C正确。
D.氧化产物与还原产物的物质的量之比是 1:2,故D错误。
故选C.
以上为百科题库网整理的关于"将1.12g铁粉加入25mL 2mol•L<sup>-1</sup>的氯化铁溶液中,充分反应后,其结果是( )"试题答案及解析,如想学习更多化学类竞赛题,欢迎访问www.baiketk.com查看搜索更多相关信息。
转载请注明:百科题库网https://www.baiketk.com/q_o6087b08f58272.html
相关题目推荐
- 列微粒与NH<sub>4</sub><sup>+</sup>具有相同质子数和电子数的是
- 与OH<sup>-</sup>具有相同质子数和电子数的粒子是( )
- 下列各组微粒不是等电子体的是
- 由等电子原理可推知O<sub>3</sub>、NO<sub>2</sub><sup>-</sup>的说法中正确的是
- 所含电子总数相等的微粒叫等电子体,下列各组微粒属于等电子体的是
- 下列各组粒子属于等电子体的是
- 根据等电子原理,由短周期元素组成的粒子,只要其原子总数和电子总数相同,均可互称为等电子体。等电子体之间结构相似、物理性质也相近。以下各组粒子不能互称为等电子体的是
- 1919年,Langmuir提出等电子体的概念:原子数相同、电子总数相同的分子互称为等电子体;此后,等电子原 理又有所发展,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同也可互称为等电子体。等电子体的结构相似、物理性质相近。根据上述原理,下列各对粒子中空间结构相似的是
- 与NO<sub>3</sub><sup>-</sup>互为等电子体的是
- 根据等电子原理,下列分子或离子中与SO<sub>4</sub><sup>2-</sup>有相似结构的是
- 根据等电子原理:由短周期元素组成的微粒,只要其原子总数相同、各微粒的电子总数相同,则互称为等电子体。以下各组微粒不是等电子体的是
- 下列各组微粒,不能互称为等电子体的是( )