铜和镁的合金2.14g完全溶于一定浓度的硝酸,若反应中硝酸被还原为NO2、NO、N2O 三种气体且标准状况下体积均为0.224L,在反应后的溶液中,加入足量的氢氧化钠溶液,生成的沉淀经过滤、洗涤、干燥后称量,质量为( )
A.3.12 g
B.4.18 g
C.4.68 g
D.5.08 g
B.4.18 g
C.4.68 g
D.5.08 g
所属分类:
化学
(免费栏目)
浏览量: 84 次
解:硝酸被还原为NO2、NO、N2O 三种气体且标准状况下体积均为0.224L,即物质的量均为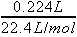 =0.01mol,所以转移的电子的物质的量为0.01mol×(5-4)+0.01mol×(5-2)+0.01mol×2×(5-1)=0.12mol.
=0.01mol,所以转移的电子的物质的量为0.01mol×(5-4)+0.01mol×(5-2)+0.01mol×2×(5-1)=0.12mol.
最后沉淀为Cu(OH)2、Mg(OH)2,金属提供的电子的物质的量等于氢氧根离子的物质的量,故最后沉淀质量等于2.14g+0.12mol×17g/mol=4.18g.
故选:B.
以上为百科题库网整理的关于"铜和镁的合金2.14g完全溶于一定浓度的硝酸,若反应中硝酸被还原为NO<sub>2</sub>、NO、N<sub>2</sub>O 三种气体且标准状况下体积均为0.224L,在反应后的溶液中,加入足量的氢氧化钠溶液,生成的沉淀经过滤、洗涤、干燥后称量,质量为( )"试题答案及解析,如想学习更多化学类竞赛题,欢迎访问www.baiketk.com查看搜索更多相关信息。
转载请注明:百科题库网https://www.baiketk.com/q_w6087b12605844.html
相关题目推荐
- 鉴定某溶液中是否含有CO<sub>3</sub><sup>2- </sup>,应该选用的试剂是
- 下列各组溶液不用其他试剂,只用组内物质相互作用便能鉴别出来的一组是:
- 下列各组中的物质充分反应后,所得溶液质量比反应前溶液质量减小的是( )
- 除去下列物质中的杂质选用试剂或操作方法不正确的是
- 下列各组变化中,只有加入酸才能一步实现的是
- 下列各组溶液,不用其他试剂就不能鉴别出来的是( )
- 下列离子能在pH=11的溶液中大量共存的是
- 鉴别下列各组物质,所用两组试剂均正确的是
- 某些金属氢化物与水反应可生成碱和氢气,如:NaH + H<sub>2</sub>O=NaOH<sub></sub>+ H<sub>2 </sub>↑。CaH<sub>2</sub>与足量Na<sub>2</sub>CO<sub>3</sub>溶液之间发生反应的产物有
- 一包不纯的Na<sub>2</sub>CO<sub>3</sub>固体,杂质可能是CaCl<sub>2</sub>、NaCl、NaHCO<sub>3</sub>中的一种或几种。现取该样品溶于水得到澄清溶液;另取样品10.6g,加入100g稀盐酸恰好完全反应,产生气体4g,则下列判断不正确的是
- 除去下列各组物质括号内的杂质,所选用的试剂及操作方法均正确的是
- 下列物质能在pH=l的溶液中共存并形成无色溶液的是